Целулитът се смята за естетично състояние и засяга повече от 85 % от жените над 20 години. Съществуват различни патогенетични теории, които обясняват целулита. Последните проучвания показват, че хистологично целулитът е подобен на цикатризация. Вероятно хипертрофията на адипоцитите оказва напрежение върху колагеновите фибри, води до тяхното пренатоварване и разкъсване. Тъй като напрежението е постоянно, TGF-β продължава да стимулира производството на колаген тип III и I от фибробластите, което не дава възможност за нормално възстановяване на колагеновата мрежа. Целта на терапията при целулит е да се зададе сигнал за производството на „правилно“ организирана колагенова мрежа и разрушаването от матрикс металопротеиназите (MMPs) на снопчетата от „неправилен“, излишен колаген III или колаген I. Целулит не може да бъде ефективно третиран само с единичен метод. Необходима е програма с последователна комбинация от методики. Например: стимулиране на липолизата, за да се намали обема на адипоцитите; след това методика за разрушаване на патологичния колаген и стимулиране на неоколагенеза за създаване на нормално изградена колагенова мрежа. Адипоцитолизата чрез вкарване отвън на различни вешества не е безопасна и води до краткотраен ефект. Медикаменти, които повишават нивата на митохондриалните несвързани протеини (UCPs), както и агонистите на пероксизомните пролифератор-активирани рецептори (PPARs) водят до „изгаряне“ на мастите локално (термогенезис) и са по-сигурният и дълготраен адипоцитолитичен метод.
Колагенът е „добрият“, защото е основната структурна единица на съединителната тъкан в органите (сърце, бял и черен дроб, бъбреци и др.), изгражда и поддържа междуклетъчното пространство в кожата, сухожилията, лигаментите, костите, мускулите, ставните капсули, фасциите. Колагенът става „лошият“ когато се пренатовари и разкъса колагеновата мрежа, а става „злият“, когато не му се даде време да се възстанови и то при продължаващо натоварване (разпъване).
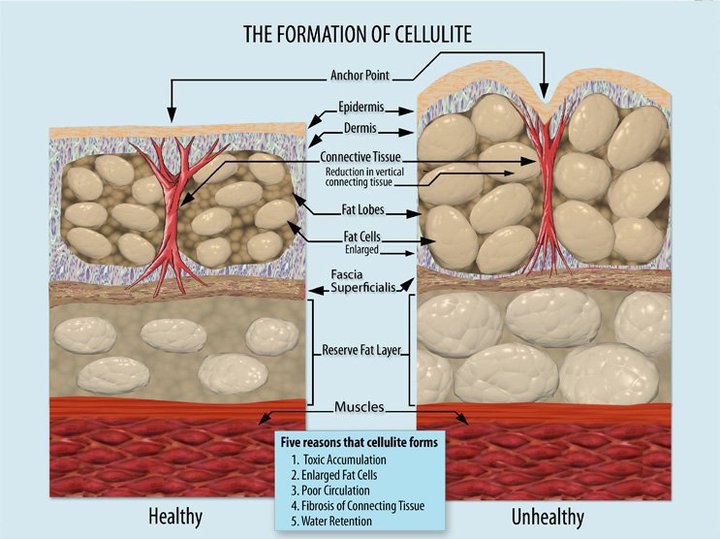
Целулитът се смята за естетично състояние и засяга повече от 85 % от жените над 20 години.1 Целулитът е промяна на топографията на кожата, която се среща главно при жените в областта на таза, долните крайници и корема. Характеризира се с поява на „портокалова кожа“.2
Съществуват различни теории, които обясняват целулита, затова може да се срещнат различни наименования на това състояние: nodule liposclerosis, oedematose fibrosclerotic panniculopathy, gynoid lipodystrophy, dermatomyolipo- sclerosis и др.1
В хиподермата адипоцитите са разположени в два слоя – външен и вътрешен. Във външния слой те са по-големи и са разположени вертикално, а във вътрешния са по-малки и са разположени хоризонтално.2 По принцип съществува разлика в строежа на хиподермата между мъжа и жената. При мъжа адипоцитите от външния слой се намират между фиброзни (колагенови) септи, които са
под наклон. Това не позволява вклиняването на хиподермата в дермата и епидермиса при хипертрофия на адипоцитите. При жената колагеновите септи са разположени вертикално и увеличаването на адипоцитите води до инвагинация в епидермиса.3 При целулит дебелината на подкожния мастен слой може да достигне средно 24,81 мм, срещу средно 4,31 мм при жени без целулит.3
Сегашните теории за патофизиологията на целулита са взаимно свързани и в някои случаи, не може да се каже кое е първично и кое е вторично. Тези теории могат да се разделят в три основни групи, но те поотделно не могат да отговорят на всички въпроси:
1) Повишена адипогенност3 – увеличената адипогенеза и хипертрофиралите адипоцити са едни от основните признаци на целулита, но например, трудно е да се отговори на въпроса „Защо при слаби жени също се открива целулит?“
2) Променен матрикс на съединителната тъкан3 – най-вече фиброплазия2 с дезорганизирани дебели снопчета от колаген тип I и тип III1, както и ангиогенезис.2
Някои автори акцентират върху повишеното количество хиалуронова киселина при целулит, което водило до повишен синтез на колаген. Други поставят повишените протеогликани като основна причина за повишеното производство на колаген, както и причина за задръжка на вода и последващи микроциркулаторни проблеми. Може би правилният отговор е един – фибробластът е този, който синтезира елементите на екстрацелуларния матрикс (колаген, хиалуронова к-на, протеогликани и др.), така че, при стимулиране на фибробласта, той ще повиши производството на всички елементи на екстрацелуларния матрикс. Възниква въпрос: „Щом има натрупани дебели снопчета колаген при целулит, защо повечето терапии предлагат отново стимулиране на колагенезата (което наистина води до някаква степен до подобрение на целулита)?“
3) Микроциркулаторни промени2 – застоят в адипозната тъкан трудно може да бъде водеща причина, а и как да се отговори на въпроса: „Защо точно на определени места от кожата настъпват тези микроциркулаторни промени, а не равномерно навсякъде?“
Нека се опитаме да си отговорим на тези въпроси и според досегашните познания на медицината, да сглобим възможно най-логичната патофизиология на целулита, която да обясни успеха и неуспеха на досегашните терапии.
Ролята на естрогените за адипоцитната хипертрофия при целулит
На първо място: Естрогените активират действието на адренергичните рецептори α-тип и насърчават акумулацията на мастна тъкан в областта на бедрата, ханша и таза.4 Те влияят на разширението на кръвоносните съдове, както и на повишението на техния пермабилитет.4 Това води до микроемболизми и микроотоци.4 Ролята на естрогените обяснява, защо началото на целулита е след пубертета, защо състоянието се влошава по време на менструация, бременност,
кърмене, естрогенна терапия (противозачатъчна или хормонозаместителна)2, защо при мъжете претърпели хормонална кастрация се появява целулит.
Жените с еднакъв BMI (Body Mass Index) могат да бъдат към два качествено различни типа: хипертрофичен – големи адипоцити с ниска клетъчност и хиперпластичен – малки адипоцити с висока клетъчност.1 При хората с нормален BMI, най-големите адипоцити са локализирани във феморалната област, следвана от глутеалната и абдоминална област. Средният размер на адипоцитите нараства с повишението на BMI.1 Някои жени с нормален BMI˂25 имат адипоцити с размер сравним със средния размер адипоцити при жени с BMI>30. Хипертрофия може обикновено да се появи при хора с различен BMI и дори при слаби индивиди.1
Ролята на колагена и неговото пренатоварване при целулит
Колагеновите фибри са основните фибри изграждащи ЕЦМ, който пък е основното скеле на съединителната тъкан. Другата част на ЕЦМ е основната субстанция – вискозна течност, съдържаща гликозамингликани и протеогликани.
Колагеновата мрежа е организирана и се поддържа от динамичното механично напрежение между нея и фибробластите, които са отговорни за нейното синтезиране.5 Механичното разтягане от страна на ЕЦМ, „разпъва“ фибробластите, които повишават продукцията на колаген и намаляват продукцията на колагеназа.5 Този процес се нарича „механотрансдукция“ – процес, при който чрез колагеновия матрикс, човешкото тяло превръща механичните натоварвания в клетъчни отговори, водещи до структурни изменения.6 Колагенът и ЕЦМ имат не само структурна, но и функционална роля – свързани са функционално с фибробластите. Колагеновата мрежа чрез гликопротеинa fibronectin се свързва и активира integrin рецептор. Integrin медиира клетъчната (фибробластна) адхезия, миграция и преживяване, също специфични диференциращи програми, свързани с тъканното развитие, поддръжка и възстановяванe.7 Той активира растежни фактори, свързани със синтеза на протеини на ЕЦМ от фибробластите: TGF-β (Transforming Growth Factor) – отговорен за синтеза на колаген, фибронектин, хиалуронова киселина и др.8
Кога се активира TGF-β?
Колагенът играе водеща роля при зарастването на рани. Първият стадий е възпалителният, през който се освобождават инфламаторни медиатори. По време на втория стадий (пролиферативния) се активират растежни фактори (най-вече TGF-β9); фибробластите продуцират нов колаген, с превалиране на колаген III спрямо колаген I – формира се гранулационна тъкан. През време на третия стадий настъпва ремодулиране на матрикса: незрелият колаген тип III се променя в зрял колаген тип I.10
TGF-β ще продължи да действа, ако по време на втората (пролиферативна) фаза механичното разпъване продължава7 – това усилва колагеногенезата и не дава възможност за преминаване в ремодулиращия стадий. Фибробластите, които във втората фаза са се трансформирали на контрактилни миофибробласти, ще продължат да продуцират нов колаген с
превалиране на колаген III. Миофибробластите са ключови ефектори при хипертрофични цикатрикси и се свързват с фибротичните процеси.7 Освен, че водят до хипертрофични цикатрикси, миофибробластите се считат за „виновни“ при склеродермия, болест на Dupuytren, както и при фиброза на сърцето и бъбреците.11
При хипертрофичен цикатрикс има главно колаген III, с изобилие от възли, съдържащи миофибробласти и много мукополизахариди, а при келоидния – дезорганизирани колаген I и колаген III.9 TGF-β е многократно повишен.12
Интересно е, че фибробластите и ЕЦМ реагират по един и същ начин при пренатоварване и разкъсване на колагеновата мрежа, независимо от тъканите, които изграждат – кожа, сухожилие, ставна капсула, фасция, анулус фиброзус, хрущялна тъкан. Настъпва усилено продуциране на колаген тип III, миофибробласти и васкуларизация, за да се коригира дефекта. Подобна хистология съществува при тендиноза,13 адхезивен капсулит,14 пролапс на междупрешленния диск,15 остеоартроза.16 Процесът хронифицира, ако натоварването продължава, като може да се достигне до макроразкъсвания в засегната тъкан, фиброзиране и калцификация.13
Ilja Kruglikov1 също достига до един логичен, но и закономерен извод – фиброзата при целулит изглежда подобна на цикатризация.1
Вероятна патофизиология на целулита
Цикличното повишение на естрогените при жената води до повишена липогенеза и адипоцитна хипертрофия. Увеличените адипоцити разпъват колагеновата мрежа, което многократно повторение може да доведе и до нейното разкъсване. Активира се TGF-β, който от своя страна стимулира фибробласта да продуцира съставки на ЕЦМ и конкретно колаген тип III и I. Това усилва микроциркулаторните промени, с резултат лимфедем и липедем. Усилващите се микроциркулаторни промени, както и увеличеното напрежение създавано от адипоцитите, отново повишава TGF-β, фибробластната стимулация и фиброзата, с превалиране на колаген III. Хронифицирането на процеса води до склерозиране на фиброзните септи (Фиг. 1).
Фигура 1: Вероятна патофизиология на целулит
Основни насоки при лечение на целулит
Лечението на целулит би трябвало да е подобно на лечението на хипертрофичен и келоиден цикатрикс.1
Каква е целта при третиране на хипертрофичните цикатрикси, келоидите?
Целта е да се зададе сигнал за производството на „правилно“ организирана колагенова мрежа и разрушаването от матрикс металопротеиназите (MMPs) на снопчетата от „неправилен“, излишен колаген III (хипертрофичен цикатрикс) или колаген I (келоиден цикатрикс).
Целулитът е състояние, което се развива през годините и ще отнеме няколко месеца преди някой ефект да може да стане забележим за клинициста и добър за пациента.3
Едно ефективно лечение на целулит трябва да може да създаде нова колагенова мрежа от правилно подреден колаген тип I, но трябва да може и да намали съществуващия патологичен колаген тип III и I. Това не може да се получи, ако не се прави нищо за намаляване на адипоцитната хипертрофия. Оставени непроменени, адипоцитите ще продължават да оказват напрежение на
колагеновата мрежа, което ще довежда до стимулиране на TGF-β и фибробластите за производство на колаген I и III, с превалиране на втория тип.
Оттук е изводът, че целулит не може да бъде ефективно третиран само с единичен метод (дори с едновременна комбинация от различни терапии в една апликация).1 Необходима е програма с последователна комбинация от методики. Например: стимулиране на липолизата, за да се намали обема на адипоцитите; след това методика за разрушаване на патологичния колаген и стимулиране на неоколагенеза за създаване на нормално изградена колагенова мрежа.
Каква методика за адипоцитолиза да се използва?
През 2011 г., Министерството на Здравеопазването на Франция издава Наредба, с която изрично забранява прилагане на адипоцитолиза чрез инжектиране на препарати за мезотерапия, инжектиране на хипоосмотични препарати, липолитични продукти (фосфотидилхолин или натриев деоксихолат), въглероден двуокис и транскутанни лазери без аспирация, тъй като те сериозно застрашават човешкото здраве.
Явно Министерството на Франция е право не само за повишения здравен риск при използването на този вид адипоцитолиза. Този начин на адипоцитолиза („разбиване“, „втечняване“) дава само временен ефект.
Не е достатъчно само да се индуцира адипоцитна липолиза, за да се извадят излишните триглицериди от тези клетки. Освободените масти ще бъдат веднага прехвърлени в циркулаторната система и обработени от черния дроб, което след това ще повиши нивата на много ниско наситените липопротеини (very LDL) в кръвта. В отговор на това, подкожният мастен слой ще ги оползотвори наново и след действието на липопротеин липаза, ще произведе повече адипоцитни триглицериди.3
От друга страна, адипоцитите имат ниво на възстановяване около 10 % за година. Количеството произведени адипоцити е генетично предопределено. Дори след тяхното премахване, броят мастни клетки може да бъде напълно възстановен.1
Най-резултатният път за премахване на адипоцитните масти би билo да се увеличат нивата на митохондриалните несвързани протеини и да „изгорят“ мастите локално (термогенезис).3
UCPs (Несвързани Протеини) допринасят за разсейване на клетъчната топлина (разсейване на митохондриалния протонен градиент, създаден от дихателната верига). Трансгенетични животни със свръхпродукция на тези протеини в адипоцитите, имат намалено количество адипозна тъкан.3 От известните медикаменти, caffeine повишава нивата на UCP-3 в подкожните адипоцити с бяла адипозна тъкан и е в синергизъм в присъствието на noradrenaline.3 Подобни съобщения за повишаване нивата на UCPs има и при приложението на ретинол.3
Пероксизомните пролифератор-активирани рецептори (PPARs) са нуклеарни транскрипционни фактори, съществуващи и в епидермиса. Агонистите на PPARs, като конюгирана линолеова киселина (CLA), също водят до адипоцитолиза, а и повишават нивата на UCPs.3 Трябва да
се има предвид, че тези PPAR рецептори са четири вида – алфа, бета, гама и делта. Алфа, бета и делта PPAR рецепторите имат адиполитичен ефект, но гама рецепторът има обратен ефект – адипогенен. Интересно е също, че нискочестотното магнитно поле (ELF-MP) инхибира експресията точно на този пероксизомен пролифератор-активиран рецептор гама 2 (PPARγ2), който е отговорен за адипогенната диференциация.17 Тези автори (Leilel Du et al.17) наблюдават, че нискочестотното магнитно поле има инхибиращ ефект върху затлъстяването. Механичното разпъване на адипоцитите при масаж инхибира тяхната диференциация и това също е свързано с понижение на PPARγ нивата.3
Заключение
Този нов патофизиологичен поглед върху целулита, разглеждащ го като нарушено възстановяване на колагеновата мрежа в адипозната тъкан, поради постоянно действащото напрежение на адипоцитната хипертрофия, дава отговор на доста въпроси. От друга страна, помага на лекаря да избере правилната стратегия за третирането на целулита и постигането на оптимални и по-дългосрочни резултати.
Референции:
1. Kruglikov I., The Pathophysiology of Cellulite: Can the Puzzle Eventually Be Solved? Journal of Cosmetics, Dermatological Sciences and Applications, 2012, 2, 1-7; http://dx.doi.org/10.4236/jcdsa.2012.21001 Published Online March 2012; http://www.SciRP.org/journal/jcdsa)
2. Rossi A. B., Vergnanini A. L., Cellulite: A Review; JEADV (2000)14, 251–262
3. Rawlings, A.V., Cellulite and Its Treatment; International Journal of Cosmetic Science, 2006, 28, 175–190
4. Leszko M., Cellulite in Menopause; Prz Menopauzalny 2014; 13(5): 298-304, DOI: 10.5114/pm.2014.46472
5. Fisher G., et al., Looking older: Fibroblast Collapse and Therapeutic Implications; Arch Dermatol. 2008 May; 144(5): 666–672; doi:10.1001/archderm.144.5.666
6. Kaux J.F., et al., Current Opinions on Tendinopathy; Journal of Sports Science and Medicine, (2011), 10, 238-253
7. Eckes B., et al., Cell-matrix interactions in dermal repair and scarring; Fibrogenesis & Tissue Repair, 2010, 3:4
8. Wilgus Т., Growth Factor–Extracellular Matrix Interactions Regulate Wound Repair; Advances in Wound Care, Vol. 1, Number 6; DOI: 10.1089/wound.2011.0344
9. Guaglitz G., et al., Hypertrophic Scarring and Keloids: Pathomechanisms and Current and Emerging Treatment Strategies; Mol Med 17 (1-2) 113-125, Jan-Feb 2011
10. Fabbrocini G., et al., Acne Scars: Pathogenesis, Classification and Treatment; Dermatology Research and Practice, Vol. 2010, Article ID 893080
11. Hinz B., et al., The Myofibroblasts, One Function, Multiple Origin, The American Journal of Pathology, Vol. 170, No. 6, June 2007; DOI: 10.2353/ajpath.2007.070112
12. Sidgwick G. P., Bayat A., Extracellular Matrix Molecules Implicated in Hypertrophic and Keloid Scarring; JEADV 2012, 26, 141-152
13. Kraushaar B., Nirschl R., Tendinosis of the Elbow (Tennis Elbow), Clinical Features and Findings of Histological, Immunohistochemical, and Electron Microscopy Studies, J Bone Joint Surg Am, 1999 Feb 01;81(2):259-278
14. Bunker T.D., Anthony P.P., The Pathology of Frozen Shoulder, a Dupuytren Like Disease, The Journal of Bone and Joint Surgery, Vol. 77B, No.5, Sept 1995
15. Adam M., Deyl Z., Degenerated annulus fibrosus of the intervertebral disc contains collagen type II; Annals of the Rheumatic Diseases, 1984; 43, 258-263, http://ard.bmj.com/ on March 30, 2016
16. Aigner T., et al., Independent Expression of Fibril-forming Collagens I, II, and III in Chondrocytes of Human Osteoarthritic Cartilage; J. Clin. Invest. 1993. 91:829-837
17. Du L., et al., Extremely low frequency magnetic fields inhibit adipogenesis of human mesenchymal stem cells; Bioelectromagnetics. 35:519–530, 2014; DOI: 10.1002/bem.21873
11
апр.
