Автор: Веселин Й. Прокопиев, Intellect Pharma, България
Цитокините са малки сигнални молекули, които модулират равновесието между хуморален и клетъчен имунен отговор. Th1 и Th17 субредици трябва да са в баланс с Th2 субредица. При възпаление има повишение на секретираните от Th1 и Th17 инфламаторни (имуностимулиращи) цитокини IL-1, IL-6, TNF–α, IL-17, INF–γ, IL-2, IL-8 и намаление на цитокините от Тh2 субредица. Обратно – при алергия имаме повишение в Th2 субредица с повишени IL-4, IL-5, IL-13. При дисбаланс е необходимо да стимулираме понижените цитокини с цитокини-агонисти и обратно – повишените би трябвало да се модулират с цитокини-антагонисти. При Vitiligo нискодозираният bFGF ребалансира взаимовръзката кератиноцит-меланоцит, а нискодозираните IL-4, IL-10, anti–IL-1 противодействат на възпалението. Нискодозираните цитокини имат добра дългосрочна клинична ефикасност при Атопичен дерматит (редукция на кожните лезии, сърбежа и безсънието). Те подобряват PASI без нежелани реакции, при пациенти с лек до умерен псориазис. Нискодозираните цитокини, самостоятелно или в комбинация, подкрепят традиционните терапии. Те могат да бъдат алтернатива при пациенти с противопоказания или странични действия към конвенционалните медикаменти.
Ключови думи: цитокини, нискодозирани цитокини, интерлевкини, секвенциална кинетична активация (SKA), anti–IL-1, IL-4, IL-10, IL-12, IFN–γ, bFGF, vitiligo, Атопичен дерматит, псориазис
Cytokines are small signal molecules which modulate the balance between humoral and cell-based immune responses. Th1 and Th17 subsets should be in balance with Th2 subset. There is a rise of the secreted by Th1 and Th17 proinflammatory (immunity stimulating) cytokines IL-1, IL-6, TNF–α, IL-17, INF–γ, IL-2, IL-8 and reduction of Тh2 subset in inflammation. In opposite side: there is a rise in Th2 subset with increased IL-4, IL-5, IL-13 in allergy. In misbalance, we need a stimulation on decreased cytokines with cytokines–agonists and in opposite side: the increased ones should be modulated with cytokines-antagonists. The Low Dose bFGF rebalances the keratinocyte-melanocyte cross-talk and the Low Dose IL-4, IL-10, anti–IL-1 counteract inflammation in Vitiligo. The Low Dose cytokines had good long-term clinical efficacy (reduction of skin lesions, itching and sleeplessness) in Atopic dermatitis. They ameliorate PASI index without adverse events in patients with slight to moderate psoriasis. The Low Dose cytokines, alone or in combination, support traditional therapies. They could be an alternative in patients with contraindications or adverse events to conventional drugs.
Key words: cytokines, low dose cytokines, interleukins, sequential kinetic activation (SKA), anti–IL-1, IL-4, IL-10, IL-12, IFN–γ, bFGF, vitiligo, Atopic dermatitis, psoriasis
Може би всеки от дерматолозите си е задавал въпросите, дали Vitiligo може да се лекува патогенетично, дали е възможна дългосрочна и безопасна имуномодулираща терапия при Атопичен дерматит и дали за лекия до умерен псориазис може да се използва имуномодулираща терапия без риск от нежелани реакции.
Нискодозираните цитокини вероятно са тази терапия, която би могла успешно и безопасно да се използва при тези състояния.
Цитокини и тяхната роля в човешкия имунитет
Цитокините (интерлевкини, tumor necrosis factor-α, интерферони, хемокини, лимфокини, монокини) са малки сигнални молекули, които участват в автокринното, паракринното и ендокринното сигнализиране като имуномодулиращи посредници. Те действат чрез рецептори и са особено важни за имунната система. Цитокините модулират равновесието между хуморален и клетъчен имунен отговор. Тяхната роля е водеща в борбата срещу инфекции, но тяхната дисрегулация е в основата на патогенезата при автоимунните и алергичните състояния.
В човешкия организъм съществуват две основни CD4 Т-клетъчни субредици в отговор на антиген-стимулация – Th1 и Th2. В последните години се установи, че към Th1 трябва да се прибави и Th17 субредица [1]. Th1 клетките освобождават TNF-α и INF-γ, които осъществяват контрол върху вътреклетъчни инфекции (клетъчен имунитет), а също водят до инфламация и автоимунност. Th17 клетките секретират IL-17, IL-22, които осигуряват екстрацелуларния имунитет и са в основата на инфламаторните и автоимунните заболявания. IL-17 от своя страна, индуцира секрецията на проинфламаторните цитокини IL-1, IL-6, TNF-α, хемокини, матрикс металопротеинази (MMPs), лиганда на рецепторния активатор на нуклеарния фактор капа бета (RANKL), циклооксигеназа-2 (СОХ-2), простагландин Е2 (PGE2), азотен окис (NO). Th2 клетките освобождават IL-4, IL-5 и IL-13, които играят главна роля за хуморалния имунитет, при алергия и астма, както и при контрол върху паразитози. Цитокините от всяка от тези субредици имат склонност да инхибират ефектите на тези от другата субредица.
Th1 и Th17 субредици трябва да са в баланс с Th2 субредица. Когато те са в рамките на физиологичните концентрации, то те са в баланс. При възпаление има повишение на секретираните от Th1 и Th17 инфламаторни (имуностимулиращи) цитокини IL-1, IL-6, TNF-α, IL-17, INF-γ, IL-2, IL-8 и намаление на цитокините от Тh2 субредица. Обратно – при алергия имаме повишение в Th2 субредица с повишени IL-4, IL-5, IL-13, а понижени проинфламаторни цитокини от Th1 и Th17 субредици. Логично, при дисбаланс ни е необходимо да стимулираме понижените цитокини с цитокини-агонисти и обратно – повишените би трябвало да се модулират с цитокини-антагонисти. Когато имаме повишени проинфламаторни цитокини при възпалителни дерматологични заболявания, би трябвало да модулираме с цитокини от Th2 субредица, а при дерматологични заболявания на алергична основа и с повишение на цитокини от Th2 фамилия – стимулираме с цитокини от Th1 субредица.
Физиологичните концентрации на сигналните молекули при здрав индивид са в пико- и фемтограми на милилитър. Пикограмите са 10-12 от грама, а фемтограмите – 10-15 от грама. По-високата или по-ниската концентрация от физиологичната води до болестно състояние. Фармакологичната концентрация (микрограма-нанограма/милилитър) на сега съществуващата цитокинова (биологична) терапия води до ефикасност, но има много нежелани реакции.
GUNA Нискодозирани цитокини
Нискодозираната Медицина на GUNA S.p.a., Италия, за първи път използва нискодозирани интерлевкини, растежни фактори, невропептиди и хормони. GUNA нискодозираните цитокини са в перорални разтвори с концентрация 10 фемтограмa/мл и са обработени с технология, наречена Секвенциална Кинетична Активация (SKA). Тази технология прави ефикасна молекулярната концентрация под минималната ефективна доза.
В Gariboldi et al., GUNA нискодозирани IL-12 и IFN-γ са използвани за in vivo лечение на експериментална алергична бронхиална астма (в животински модел) с много окуражаващи резултати [2]. Cardani et al. демонстрират, че пероралното приложение на GUNA нискодозирани IL-10 и anti-IL-1 могат да контролират чревното възпаление при in vivo животински модел на IBD (Възпалително Заболяване на Червата) [3]. Barygina et al. съобщават, че GUNA нискодозираните IL-4, IL-10, bFGF (базисен фибробласт растежен фактор) и β-endorphin статистически значимо супресират продукцията на ROS (свободни кислородни радикали) във фибробласти от кожните лезии при пациенти с псориазис [4]. В едно рандомизирано активно-контролирано клинично проучване, Martin-Martin et al. показват активността на GUNA нискодозирани IL-4, IL-10 и anti-IL-1 сравнени с DMARDs (болест-модифициращи анти-ревматични лекарства) в поддържането на ниска активност на болестта при пациенти с ревматоиден артрит в ремисия, след терапия с биологични продукти [5].
Нискодозирани цитокини и Vitiligo
Досега Vitiligo винаги се е свързвало с увредени меланоцити и оттам – нарушен синтез на меланин. Напоследък изследвания доказват, че водеща роля имат увредени кератиноцити на фона на възпаление и нарушената им комуникация с меланоцитите, с резултат – пасивна меланоцитна смърт. Оказва се, че епидермалните меланоцити формират функционална и структурна единица със съседните кератиноцити [6]. Растежни фактори продуцирани от близките кератиноцити, регулират пролиферацията и диференциацията на меланоцитите [6]. Кератиноцитите продуцират и отделят базисния фибробласт растежен фактор (bFGF), ендотелини (ETs), стволовоклетъчния фактор (SCF) и затова кератиноцитната увреда може да има значителен ефект върху преживяването на меланоцитите [6].
Може да се каже, че за появата на Vitiligo значение има взаимодействието между три основни фактора: възпаление, оксидативен стрес и кератиноцитна/меланоцитна апоптоза. Съществуват значително по-високи нива на TNF-α, IL-1β, IL-6 и IL-17 в депигментираната, отколкото в перилезионната, не-лезионната и здрава кожа при Vitiligo [6, 7]. Повишените TNF-α нива инхибират вътреклетъчни сигнални пътища и могат да доведат до повишена кератиноцитна апоптоза [6]. От друга страна, TNF-α и IL-17 индуцират ROS (свободни кислородни радикали) в клетката, водещи до оксидативен стрес [7, 8]. Оксидативният стрес се счита за един от възможните патогенетични процеси за кератиноцитна/меланоцитна загуба [6, 7]. ROS могат да се индуцират и при механична травма, химична увреда, дългосрочно ултравиолетово облъчване, митохондриална увреда, компрометиран антиоксидантен статус [6, 7]. Интересно е също, че IL-17 индуцира продукцията на IL-1β, IL-6 и TNF-α от кератиноцити и фибробласти, което може да причини апоптоза на меланоцитите [7]. По време на апоптозата, модифицирането на кератиноцитните/меланоцитните антигени може да предизвика появата на вътреклетъчни или свързани с мембраната автоантигени, които имат потенциала да стимулират имунитета [6, 7].
Увредата на кератиноцитите може да има значителен ефект върху преживяването на меланоцитите [6]. Нивата на SCF, ендотелин-1 и bFGF са значително по-ниски в депигментирания епидермис, отколкото тези, в нормално пигментиран епидермис на пациенти с Vitiligo [6]. Кератиноцитната апоптоза може да индуцира по-малка кератиноцитна продукция на меланоцитни растежни фактори, водеща до пасивна меланоцитна смърт с развитие на Vitiligo [6] (Фиг. 1).
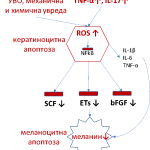
Фиг. 1 Кератиноцитна и меланоцитна апоптоза при Vitiligo (УВО – ултравиолетово облъчване, ROS – свободни кислородни радикали, NFkB – нуклеарен фактор капа бета, SCF – стволовоклетъчен фактор, ETs – ендотелини, bFGF – базисен фибробласт растежен фактор)
С оглед досегашните познания за заболяването, при Vitiligo е необходима терапия, която да инхибира, още по-добре, ако може да имуномодулира проинфламаторните цитокини. Това ще доведе до намаляване на възпалението и свързания с него оксидативен стрес, както и предотвратяване на кератиноцитната/меланоцитната апоптоза. Желателно е и възстановяване на връзката кератиноцит-меланоцит, за да се стимулира меланоцитната пролиферация и диференциация.
Много проучвания съобщават, че Th2-секретираните цитокини IL-4 и IL-10 имуномодулират проинфламаторните цитокини. В свое проучване Hahn & Ghoreschi показват, че IL-4 инхибира секрецията на IL-1β и IL-6 в епидермални клетки, а екзогенният IL-4 потиска експресията на IL-17A [9]. Zhang et al. от своя страна демонстрират, че IL-10 може да понижи синтеза на проинфламаторни цитокини и хемокини, като IL-1, IL-6 и TNF-α [10], a Gu et al. доказват, че IL-10 инхибира и експресията на IL-17 [11].
Сегашните терапии за Vitiligo не са напълно ефективни [12]. Досега не е имало терапия, която да таргетира нарушеното взаимодействие между кератиноцит и меланоцит и едновременно да имуномодулира повишените проинфламаторни цитокини.
В свое проучване Lotti et al., използват ребалансиращото действие на GUNA нискодозиран bFGF върху промененото кератиноцит/меланоцит взаимодействие и ребалансирането на промененото Th1/Th2 съотношение чрез приложение на анти-инфламаторни цитокини и антитела (GUNA нискодозирани IL-4, IL-10, anti-IL-1) [12]. Всички GUNA нискодозирани цитокини са приложени заедно, 2 пъти по 20 капки, за 9 последователни месеца. В това проучване е установена липса на прогресия на Vitiligo, когато са приложени перорални нискодозирани цитокини. Нискодозираните цитокини ребалансират взаимовръзката кератиноцит/меланоцит и противодействат на възпалението при Vitiligo. Протоколът с нискодозирани цитокини за лечение на Vitiligo е логичен, безопасен и добре понасящ се, което позволява използването му за системна терапия на болестта [12].
Нискодозирани цитокини и Атопичен дерматит
Атопичният дерматит (AD) винаги се е разглеждал преди всичко като нарушение на бариерната функция на кожата. Известно е, че мутациите в гена на протеина filaggrin (съединяващ кератиновите филаменти, които формират клетъчния скелет на епидермалните клетки) могат да индуцират намаляване на естествените овлажняващи фактори, включващи натриева пирролидонова карбонова киселина, уроканова киселина и липопротеинови компоненти, специално cерамидите [13]. Като прибавим намаляването на SPINK5 (serine protease inhibitor Kazal type 5, който играе роля в междуклетъчните прикрепвания) и claudin-1 (трансмембранен протеинов компонент на здрави свързвания – TJs) [13], придобиваме почти пълната картина за патогенезата на нарушението на кожната бариерна функция.
Нека не забравяме обаче, че освен генетичният полиморфизъм, дефектите в епидермалните бариери и факторите на заобикалящата среда, съществува още един фактор в патогенезата на AD – дисрегулация на различни типове имунни отговори [13].
Различните проучвания показват съществуването на пролиферация най-вече на Th2 клетки при Атопичен дерматит. CD4 клетките се диференцират в Th2 клетки под въздействието на протеина TSLP (тимусен стромен лимфопоетин), който стимулира дендритните клетки. Th2 клетките освобождават IL-4, IL-5 и IL-13 [13]. Th2 клетките продуцират и IL-31, който предизвиква пруритус [13]. Експресията на TSLP в кератиноцитите се индуцира от механична увреда, както и от стимулация на Toll-like рецепторите (TLR) 2, 5 и 6 [13].
Тимусният стромен лимфопоетин също стимулира мастоцитите, базофилите и еозинофилите, които играят ключова роля в кожното възпаление. Доказано е, че одраскването може да повиши TSLP и да утежни лечението на AD, водещо до порочен кръг между сърбеж, одраскване, повишение на TSLP и повишение на Th2 [13].
Необходима е имуномодулация на Th2 клетките при AD. IFN-γ е мощен модулатор на Th2 лимфоцитен клон, а IL-12 е силен сигнал за индукция на IFN-γ [14].
IFN-γ е известен антагонист на Th2 имунен отговор и може да намали еозинофилията в кръвта, но грипоподобни симптоми са често срещани нежелани реакции и ограничават употребата на това лечение (във фармакологични дози) в клиничната практика [13].
Защо да се използват точно Нискодозирани цитокини?
Интерфероните и цитокините в концентрация 10 fg/ml, която е физиологична концентрация, представляват „сигнални молекули“, можещи да окажат имуномодулиращо действие върху таргетни клетки. При дисбаланс в имунната система, тези биологични молекули могат да възстановят баланса на патологично повишени лимфоцитни клонове [14].
В едно двойно-сляпо, рандомизирано, плацебо-контролирано клинично проучване за дългосрочно лечение на 80 деца с хронична екзема, Carello et al. заключават, че Нискодозираните цитокини имат добра дългосрочна клинична ефикасност (редукция на кожните лезии, сърбежа и безсънието) [14].
Една от възможните дозировки за лечение на лек до умерен Атопичен дерматит с GUNA Нискодозирани цитокини е: IFN-γ и IL-12, приложени перорално, 2 по 8 капки дневно за деца на възраст ≤ 5 години, 2 по 15 капки дневно за деца на възраст > 5 години, за 6 месеца. При възрастни е 2 по 20 капки дневно, също за 6 месеца. Терапевтичните цикли могат да бъдат повторени, в зависимост от клиничната история на всеки пациент, тежестта на заболяването и индивидуалния отговор на пациента.
Нискодозирани цитокини и псориазис
Отдавна е доказана ролята на проинфламаторните цитокини в патогенезата на псориазис. Th1 и Th17 клетки, диференцирани съответно от IL-12 и IL-23, преминават в кожата. Th1 секретира IFN-γ и TNF-α, a Th17 – IL-17 и IL-22, които стимулират кератиноцитната активация и пролиферация, водещи до формиране на псориатична плака. Псориатичният кератиноцит е под влиянието на имуномедииран хроничен инфламаторен отговор [15].
Активираните кератиноцити продуцират проинфламаторните цитокини IL-1β, IL-6 и TNF, които активират отново дендритната клетка и водят до нов инфламаторен кръг. Този порочен кръг е в основата на продължителната имунопатологична прогресия на псориазис [15] (Фиг. 2).
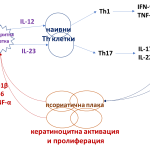
Фиг. 2 Порочен имунопатологичен инфламаторен кръг при псориазис
Съвременната анти-цитокинова биологична терапия действа мощно и ефикасно при тежките случаи на псориазис, но има множество нежелани реакции и поради това не се използва масово за лечение на лекия и умерен псориазис. Биологичната терапия инхибира почти напълно таргетирания цитокин, унищожавайки и неговата „полезна“ дейност. Противоположно на това, имуномодулацията с нискодозирани цитокини води до противодействие и балансиране на патологично увеличените цитокини, запазвайки тяхната физиологична наличност и тяхната защитна функция.
Можем ли да използваме една безопасна перорална имуномодулираща терапия при лекия до умерен псориазис?
GUNA Нискодозирани цитокини е тази терапия, с която може да се действа имунологично и при лек до умерен псориазис или тази терапия, която може да бъде допълнение към локалната терапия на пациента. GUNA Нискодозирани цитокини имуномодулират проинфламаторните цитокини и прекъсват порочния имунопатологичен кръг при псориазис.
В мултицентрово, двойно-сляпо, рандомизирано, плацебо-контролирано клинично проучване, Roberti et al. показват, че нискодозирaните цитокини подобряват PASI без нежелани реакции, при пациенти с лек до умерен псориазис [16].
Lotti предлага GUNA нискодозирани anti-IL-1, IL-4 и IL-10 при лечение на псориазис в доза 2 пъти по 20 капки, за 6 месеца. Комбинирането на тези интерлевкини и антитела с UVA-1-лазер терапия демонстрира статистическо значимо усилване на действието в подобряване на PASI-индекса [17].
Заключение
Нискодозираните цитокини, самостоятелно или в комбинация, подкрепят традиционните терапии. Те са в състояние да модулират имунологичния отговор в редица дерматологични заболявания с нарушен имунен баланс и то без нежеланите реакции на използваната в момента биологичната терапия. За някои от дерматологичните заболявания, Нискодозираните цитокини представляват единственото възможно патогенетично лечение.
Нискодозираните цитокини могат да бъдат алтернатива при пациенти с противопоказания и със странични действия към конвенционалните медикаменти. Това лечение може да се използва като дългосрочна, финансово достъпна поддържаща терапия.
Разбира се, необходими са по-нататъшни проучвания с Нискодозираните цитокини, за да може напълно да се оцени ефективността им при имунозависимите дерматологични заболявания.
Референции:
- Truchetet M.E., Djavad Mossalayi, Boniface K., IL-17 in the rheumatologist’s line of site, BioMed Research International, Vol. 2013, Article ID295132, http://dx.doi.org/10.1155/2013/295132
- Gariboldi S., Palazzo M., Zanobbio L., et al., Low dose oral administration of cytokines for treatment of allergic asthma, Pulm Pharmacol Ther.2009 Dec;22(6):497-510. doi: 10.1016/j.pupt.2009.05.002. Epub 2009 May 21
- Cardani D., Dusio GF., Luchini P., et al., Oral administration of interleukin-10 and anti-IL-1 antibody ameliorates experimental intestinal inflammation, Gastroenterology Research. 2013;6(4):124–33; Published online 2013 Sep 9. doi: [4021/gr556w]
- Barygina V., Becatti M., Lotti T., et al., Low dose cytokines reduce oxidative stress in primary lesional fibroblasts obtained from psoriatic patients, J Dermatol Sci. 2016;83(3):242-4; https://doi.org/10.1016/j.jdermsci.2016.06.002
- Martin-Martin LS., Giovannangeli F., Bizzi E., et al., An open randomized active-controlled clinical trial with low-dose SKA cytokines versus DMARDs evaluating low disease activity maintenance in patients with rheumatoid arthritis, Drug Design, Development and Therapy 2017:11, 985–994
- Lee AY., Role of Keratinocytes in the Development of Vitiligo, Ann Dermatol, Vol. 24, No. 2, 2012, http://dx.doi.org/10.5021/ad.2012.24.2.115
- Laddha, Dwivedi M., Mansuri M., et al., Vitiligo: interplay between oxidative stress and immune system, 2013 John Wiley & Sons A/S, Experimental Dermatology, DOI: 10.1111/exd.12103, www.blackwellpublishing.com/EXD
- Vlahopoulos S., Boldogh I., Casola A., Brasier AR., Nuclear factor-kappaB-dependent induction of interleukin-8 gene expression by tumor necrosis factor alpha: evidence for an antioxidant sensitive activating pathway distinct from nuclear translocation, 1999 Sep 15;94(6):1878-89
- Hahn M., Ghoreschi K., (2017) The role of IL-4 in psoriasis, Expert Review of Clinical Immunology, Vol. 13, No.3, 171-173, DOI: 10.1080/1744666X.2017.1279054
- Zhang Q., Chen B., Yan F., et al., Interleukin-10 Inhibits Bone Resorption: A Potential Therapeutic Strategy in Periodontitis and Other Bone Loss Diseases BioMed Research International, Volume 2014, Article ID 284836, 5 pages, http://dx.doi.org/10.1155/2014/284836
- Gu Y., Yang J., Ouyang X., et al., Interleukin 10 suppresses Th17 cytokines secreted by macrophages and T cells, Eur J Immunol. 2008 July; 38(7): 1807–1813. doi:10.1002/eji.200838331
- Lotti T., Hercogova J., Wollina U., et al., Vitiligo: Successful Combination Treatment Based on Oral Low Dose Cytokines and Different Topical Treatment, Journal of Biological Regulators & Homeostatic Agents, 29, no. 1 (S), 53-58 (2015)
- Kanchongkittiphon W., Gaffin J., Phipatanacul W., Child with Atopic Dermatitis, Ann Allergy Asthma Immunol. 2015 January; 114(1): 6–11, doi:10.1016/j.anai.2014.08.016
- Carello R., Ricottini L., Miranda V., et al., Long-term treatment with low-dose medicine in chronic childhood eczema: a double-blind two-stage randomized control trial, Italian Journal of Pediatrics (2017) 43:78; DOI 10.1186/s13052-017-0393-5
- Gaspari А., Tyring С., New and emerging biologic therapies for moderate-to-severe plaque psoriasis: mechanistic rationales and recent clinical data for IL-17 and IL-23 inhibitors, Dermatologic Therapy, Vol. 28, 2015, 179–193
- Roberti M.L., Ricottini L., Capponi A., et al., Immunomodulating treatment with low dose interleukin-4, interleukin-10 and interleukin-11 in psoriasis vulgaris, Journal of Biological Regulators & Homeostatic Agents, 28, no.1, 0-0 (2014)
- Lotti T., [Successful combination treatment for psoriasis with phototherapy and low-dose cytokines: A spontaneous, retrospective observational clinical study], Der Hautarzt 66(11), October 2015; DOI: 10.1007/s00105-015-3698-6

